equilíbrio de fases / phase equilibrium.
Situação, do ponto de vista termodinâmico, em que duas [líquido (L) / vapor (V)] ou mais fases estarão em equilíbrio em um sistema fechado quando: houver equilíbrio térmico entre as fases (TL = TV); houver equilíbrio mecânico entre as fases (PL = PV); houver equilíbrio químico entre as fases (GL = GV ). Onde T é a temperatura absoluta, P é a pressão absoluta e G é a energia livre de Gibbs.
→ Pode-se fazendo:
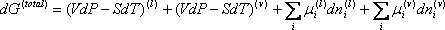
No equilíbrio, a pressão é constante (dP=0), a temperatura é constante (dT=0) e, G também é constante (dG=0),
então:
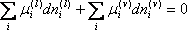
Onde:
µ i é o potencial químico do componente i na mistura. Como o sistema é fechado 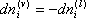
Então:
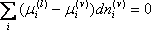
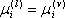 para todo i = 1, 2,...
para todo i = 1, 2,... Tem-se então o critério rigoroso de equilíbrio líquido-vapor para um sistema, sob valores constantes de pressão e temperatura, ou seja, no equilíbrio o potencial químico de cada componente deve ser o mesmo em ambas as fases. Podemos generalizar esta constatação para qualquer número de fases, para o qual o potencial químico de cada componente deve ser o mesmo em todas as fases. A diferença de potencial químico é a força motriz que move uma espécie de uma fase para a outra (difusão molecular). No equilíbrio, a força motriz é zero (os potenciais químicos se igualam) e a transferência de massa cessa.